1. 申请瑞德西韦抗2019新型冠状病毒的用途专利是武汉病毒研究所的权利;
2. 武汉病毒研究所2020年1月21日提交的申请,有获得授权的可能性,其可能获得授权的主题是“瑞德西韦在制备用于治疗2019新型冠状病毒药物中的应用”;
3. 吉利德公司于2016年9月16日提交的用途专利申请,其可能获得授权的主题是“瑞德西韦在制备治疗SARS或MERS病毒药物中的应用”;
4. 基于上述两种可能授权的主题,拟实施武汉病毒研究所的申请技术方案不太可能落入吉利德公司2016年冠状病毒用途申请的保护范围,但必然会落入2011年的瑞德西韦化合物专利的保护范围;
5. 即便启动强制许可,或者吉利德公司授权许可相关单位实施其专利,要在短时间内完成临床研究、制备出符合新药审批标准的制剂仍将面临技术上的困难,因而此时讨论强制许可,还为时过早。
2020年1月31日,《新英格兰医学杂志》(NEJM)在线发表了一篇名为《首例美国2019新型冠状病毒》的文章[1],该文提及,美国首例确诊新型冠状病毒病例在住院的第7天晚上,接受了吉利德科学公司(“吉利德公司”)正在开发中的抗病毒药物Remdesivir(“瑞德西韦”或“瑞得西韦”),第8天,该名患者的临床症状明显改善,截止2月6日,已全部痊愈。
根据全球临床试验数据库(ClinicalTrials.gov)显示的信息, 2020年2月5日在中国由首都医科大学申办,北京中日友好医院曹彬教授牵头,启动瑞德西韦对抗2019-nCoV病毒的3期临床试验,预计于2020年4月27日结束。据最新消息,该临床试验已经于2月5日正式启动。
2020年2月4日,中国科学院武汉病毒研究所官网宣布,在《细胞研究》(《Cell Research》)上发表了一篇题为《瑞德西韦和磷酸氯喹能在体外有效抑制新型冠状病毒(2019-nCoV)》[2],并宣布已于2020年1月21日申报了中国发明专利(抗2019新型冠状病毒的用途),并将通过PCT途径进入全球主要国家和地区。
在引发网络热议的当下,我们试着从医药和专利相关的知识产权角度予以梳理阐明。
一、武汉病毒研究所的新用途专利申请的主题是什么?如何能够获得授权?
发现一个已知化合物的新用途,通过专利予以保护是值得鼓励和提倡的。因此,武汉病毒研究所在发现瑞德西韦抗2019新型冠状病毒活性之后,申请瑞德西韦抗2019新型冠状病毒的用途专利是武汉病毒研究所的权利,这无可厚非。而且,即便使用了瑞德西韦的专利产品,但因为申请专利的行为属于专利法第六十九条的“(四)专为科学研究和实验而使用有关专利的”的行为,故不视为侵犯专利权的行为。
而另一方面,虽然武汉病毒研究所提交了专利申请,但还需要经过国家知识产权局,或其他国家和地区的专利实质审查,以确认是否满足中国专利法或者其他国家和地区的专利法的相关规定,从而才能够获得授权。只有专利授权了之后,专利权人才有权利依据该授权的专利主张权利。当然,即便专利被授权了,还可能会被任何单位或个人提起专利无效。故,由于武汉病毒研究所的专利刚刚于2020年1月21日提交,还未公开,更未授权,在此时谈“不主张权利”有些为时过早。
回到武汉病毒研究所的专利申请,其专利申请保护的主题是什么?
如前所述,由于该申请刚刚提交,并未公开,因此,公众还无从得知其专利的权利要求到底保护了什么内容。
但基于目前已经公开的内容,我们可以确定,武汉病毒研究所申请的是已知化合物的新用途申请。
根据武汉病毒研究所的前述官网可知,其提交了“瑞德西韦抗2019新冠状病毒的用途”的专利申请(简称为“目标申请”)。
基于上述信息和我们的既有经验,我们判断,武汉病毒研究所可能的权利要求主题是下述之一或其结合:
(1)瑞德西韦在制备用于治疗由2019新型冠状病毒引起的疾病的药物中的应用;
(2)瑞德西韦在制备用于治疗由冠状病毒引起的疾病的药物中的应用;
(3)包含瑞德西韦的抗病毒通式化合物用于治疗由2019新冠状病毒引起的疾病的药物中的应用;或者
(4)包含瑞德西韦的抗病毒通式化合物用于治疗由冠状病毒引起的疾病的药物中的应用。
这四者的保护范围大致如下:
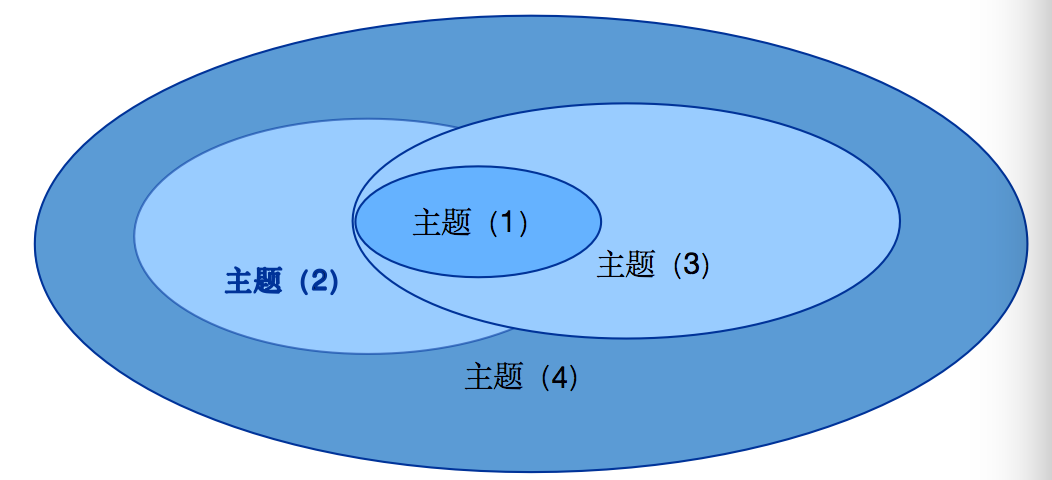
即,主题(1)的保护范围在这四种中最小,主题(2)和主题(3)均包含主题(1),而主题(4)在这四种中保护范围最大,涵盖了前三者的主题。
这样的四种主题谁有可能获得授权?这将取决于专利申请的内容,以及现有技术公开的内容。
其中,第(2)至(4)种主题涉及瑞德西韦的上位概念(如吉利德公司如下采用的式I化合物或其药学上可接受的盐或酯)或者2019新型冠状病毒的上位概念(如冠状病毒等等),除了考虑新颖性和创造性的问题以外,还需考虑说明书充分公开以及权利要求的支持问题。
为简便计,本文仅针对新颖性和创造性进行分析,故主要以第(1)种情形进行下述分析。
需要说明的是,本文分析2019新型冠状病毒,是以截止发稿时,普遍认为该冠状病毒与之前已有的SARS或MERS冠状病毒虽有相似性,但结构不同为基础进行分析的。
●关于对比文件 ●
根据中国专利法的相关规定,能够评价新颖性的对比文件是在目标专利/申请的申请日之前公开的现有技术,或者属于申请在先且公开在后的抵触申请。而能够评价创造性的对文件只能是现有技术。
基于此可知,《Science》以及《新英格兰医学杂志》(NEJM)上的文章公开日期均晚于武汉病毒研究所的申请日(2020年1月21日),而且,这些都并非专利申请,故,它们不会影响武汉病毒研究所专利申请的新颖性和创造性。
那武汉病毒研究所的目标申请是否能够获得授权,依据目前初步检索到的证据可知,主要可能构成障碍的现有技术应该来自原研吉利德公司的在先专利申请。
在此需要说明的是,由于还未对上述主题进行全面的检索,故不排除存在其他在2020年1月21日之前已经公开的现有技术以及在2020年1月21日之前申请但在该日期之后公开的抵触申请文献的可能性。若有出现,其判断标准和下述评述一致。
● 新颖性 ●
吉利德公司围绕瑞德西韦的专利布局涵盖了化合物(CN103052631B,专利号:ZL201180035776.1,“776号化合物专利”已在中国获得授权,用于治疗副黏病毒科病毒感染的方法和化合物)、用途(CN108348526A,申请号 201680066796.8,“796号用途申请”,治疗沙粒病毒科和冠状病毒科病毒感染的方法)、晶型(CN110636884A,申请号201880028988.9,“988晶型申请”,瑞德西韦的结晶形式)和制剂(WO2019014247A)等方面。
具体地,776号化合物专利保护如下结构的瑞德西韦化合物以及用于制备治疗副黏病毒科病毒感染的药物的用途,并公开了瑞德西韦抑制副黏病毒科病毒的聚合酶。
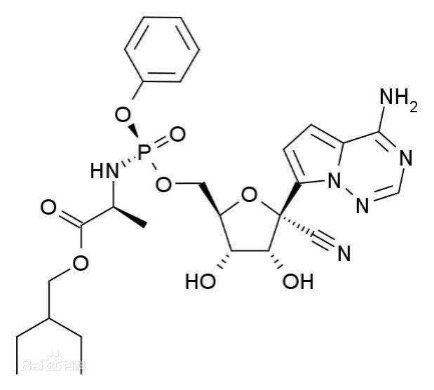
(瑞德西韦)
796号用途申请于2016年提出瑞德西韦用于治疗冠状病毒科病毒感染的用途,并列举了SARS、MERS、229E、NL63、OC43和HKU1等冠状病毒科病毒,还在实施例中验证了瑞德西韦对抗SARS和MERS病毒的活性;此外该申请还公开了瑞德西韦抑制沙粒病毒科病毒和冠状病毒科病毒的聚合酶。
796号用途申请公开文本的权利要求39请求保护如下技术方案:
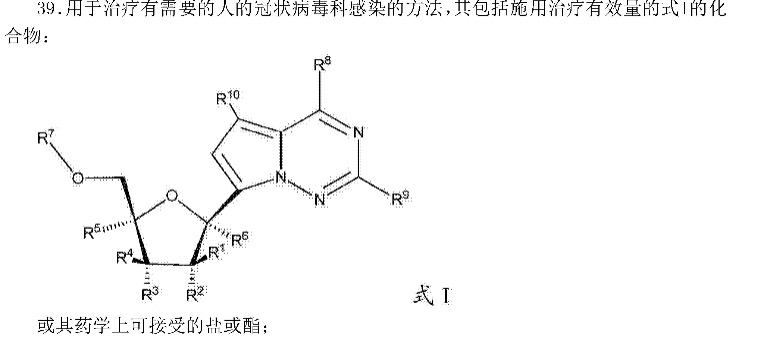
目前的权利要求是疾病的治疗方法,属于专利法第二十五条的“疾病的诊断和治疗方法”,不属于专利权的保护客体。但可以修改为如“式I的化合物或其药学上可接受的盐或酯在制备用于治疗有需要的人的冠状病毒科感染的药物中的应用”的瑞士型权利要求。
988号晶型申请要求保护瑞德西韦的结晶形式,同时在背景技术部分提及了瑞德西韦具有针对沙粒病毒科、冠状病毒科、丝状病毒科、副粘病毒科病毒以及黄病毒科病毒的广泛的抗病毒活性。
由此可见,对于武汉病毒研究所可能申请的第一个主题“(1)瑞德西韦在制备用于治疗由2019新冠状病毒引起的疾病的药物中的应用”和第三个主题“(3)包含瑞德西韦的抗病毒通式化合物用于治疗由2019新冠状病毒引起的疾病的药物中的应用”,因为均涉及2019新冠状病毒的具体限定,而吉利德公司的上述专利和申请中均没有公开武汉病毒研究所的2019新型冠状病毒这一具体的病毒,因此,这两个主题的申请具有新颖性。而第二个主题“(2)瑞德西韦在制备用于治疗由冠状病毒引起的疾病的药物中的应用”和第四个主题“(4)包含瑞德西韦的抗病毒通式化合物用于治疗由冠状病毒引起的疾病的药物中的应用。”因为其中的瑞德西韦和冠状病毒都已经被吉利德公司的796号用途申请和988号晶型申请予以披露,故这两个主题将不具有新颖性。
故基于此,以下,也仅需要针对第一个主题和第三个主题的创造性进行判断。
(1)瑞德西韦在制备用于治疗由2019新冠状病毒引起的疾病的药物中的应用;(3)包含瑞德西韦的抗病毒通式化合物用于治疗由2019新冠状病毒引起的疾病的药物中的应用。
●创造性 ●
对于目标申请的创造性的判断,首先需要考虑现有技术中是否给出了将瑞德西韦用于治疗由2019新型冠状病毒引起的感染的技术启示。
吉利德在先的796号用途申请和988号晶型申请中已经公开了瑞德西韦可治疗如SARS或MERS类冠状病毒科病毒引起的感染,故将目标申请请求保护的技术方案与相比,其区别仅在于,武汉病毒研究所的目标申请请求保护2019新型冠状病毒,而在先申请2和申请3仅仅涉及如SARS或MERS类冠状病毒。
就技术效果而言,虽然武汉病毒研究所目标申请的内容还无从得知,但我们理解,其2月4日在《细胞研究》上发表的文章中记载了瑞德西韦在Vero E6细胞上的体外实验数据,如下图所示:
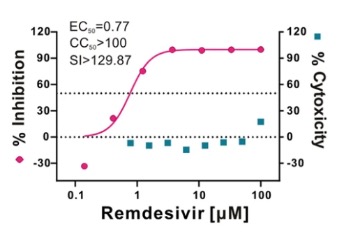
由此可以获知,在Vero E6细胞上,瑞德西韦对2019-nCoV的半数有效浓度EC50=0.77 μM(微摩尔每升),半数细胞毒浓度CC50>100 μM(微摩尔每升),选择指数SI大于129。我们推测,在武汉病毒研究所的该新用途专利申请中应该会使用这些数据或者至少应该包含这些数据。相对应地,吉利德公司的796号用途申请中公开了瑞德西韦(化合物32)针对MERS和SARS的体外EC50和CC50数据,如下所示:
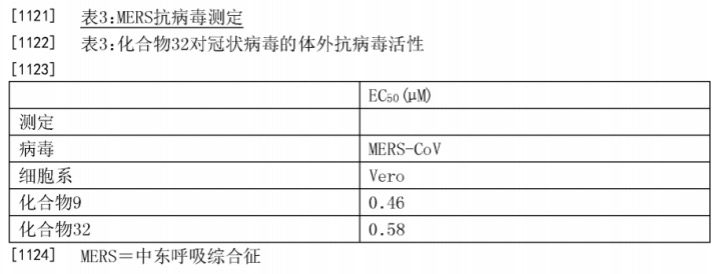
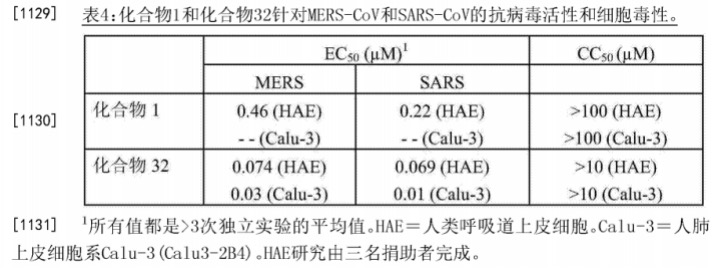
在上述796号用途申请中,表4是采用HAE(人类呼吸道上皮细胞)和Calu-3(人肺上皮细胞系Calu-3(Calu3-2B4))模型获得的相应数据,而武汉病毒研究所采用的是Vero E6细胞(非洲绿猴肾细胞)模型。由于采用的实验模型不同,不宜直接将所得数据进行比较。不过,我们注意到,上述表3中的数据同样采用了Vero E6细胞模型,这两者有可比性。
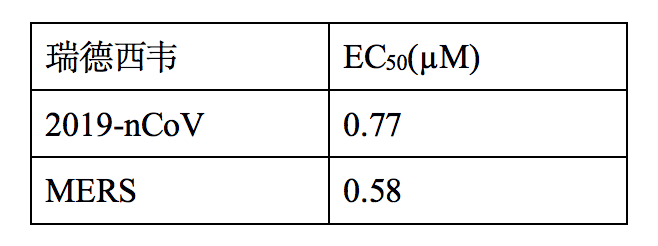
由此可见,瑞德西韦对于2019新型冠状病毒与MERS的抗病毒效果相当。因此,相对于吉利德公司的现有技术,武汉病毒研究所的申请提供了一种瑞德西韦用于治疗2019新型冠状病毒的应用。
综上可见,对于创造性的判断而言,我们认为,可以从如下方面陈述目标申请的创造性:
第一,吉利德的现有技术申请中没有记载瑞德西韦用于对抗2019新冠病毒,且该新冠病毒与SARS或者MERS冠状病毒不同,还没有任何现有技术证实一种药物可以同时对这些冠状病毒均有效,因而,尽管现有技术公开了瑞德西韦对SARS或MERS冠状病毒有作用,但本领域技术人员无法预期其对于2019新冠病毒也有作用;
第二,假定文章发表的内容记载在专利申请文件中,则由于瑞德西韦对2019-nCoV的细胞毒性很小,并且选择性很高,在所测试的7种化合物中具有最小的EC50值和最高的选择性;
第三,在疫情发生至今,已经大量的科研人员从已知的抗病毒药物中筛选对新冠病毒有效的药物,但哪种药物有效并不能预期。
此外,武汉病毒研究所的新用途专利申请中还可能会包含另外的没有在文章中披露的数据,也可能有助于证明瑞德西韦对抗2019新型冠状病毒取得了预料不到的技术效果。
因此,我们认为,若武汉病毒研究所的试验数据能够支持其结论,即便该数据是体外活性数据,则请求保护瑞德西韦用于制备治疗由2019新冠病毒引起的疾病的药物的新用途专利申请还是有希望获得授权的。
●其他可能的现有技术 ●
在检索过程中,我们还注意到,Timothy P. Sheahan于2020年1月10发表在《Nature Communication》“Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV”的文章中提出,基于他们对MERS的研究成果,他们预期瑞德西韦可能能够在将来改善新型的冠状病毒感染引起的疾病。
对于该文献,其投稿时间是2019年1月3日,我们理解,并未公开2019新冠病毒,故不能影响武汉病毒研究所的申请新颖性。而对于创造性的影响,其与吉利德公司的上述文献类似,故不再单独分析。
●关于补充试验数据 ●
有观点认为,美国当地时间2020年1月15日,中美签订第一轮签订贸易协定第三和第四节中涉及“申请日后的补充实验数据”的相关规定,其中第1.10规定,“中国应允许药品专利申请人在专利审查程序、专利复审程序和司法程序中,依靠补充数据来满足可专利性的相关要求,包括对公开充分和创造性的要求”。据此认为,无论是吉利德的2016年用途申请,还是武汉病毒研究所2020年的申请,因都提到了治疗冠状病毒的应用,故可以通过在后试验数据予以证明相关专利性。
但我们认为,关于补充试验数据的该协定还未有具体细则出台,故如何实施还有待确定。但补充试验数据予以考虑的一个前提是,其不得违背先申请制的原则。事实上,依据中国已有司法实践和《审查指南》的相关规定,也可以确定,并非任何在后补充的试验数据均可以接受。具体而言,
最高人民法院于2018年6月1日对外发布的《关于审理专利授权确权行政案件若干问题的规定(一)(“征求意见稿”)》第十三条规定:“化学发明专利申请人、专利权人在申请日以后提交实验数据,用于进一步证明说明书记载的技术效果已经被充分公开,且该技术效果是本领域技术人员在申请日根据说明书、附图以及公知常识能够确认的,人民法院一般应予审查。化学发明专利申请人、专利权人在申请日以后提交实验数据,用于证明专利申请或专利具有与对比文件不同的技术效果,且该技术效果是本领域技术人员在申请日从专利申请文件公开的内容可以直接、毫无疑义地确认的,人民法院一般应予审查。”
而且,最高人民法院在有关试验数据的判决中,已经在实践中采用了上述判断标准。
在【(2012)知行字第41号)】裁定(“吡格列酮与格列美脲的联用药物”)中,“创造性判断中,当专利申请人或专利权人在申请日后补充对比试验数据以证明专利技术方案产生了意料不到的技术效果时,接受该实验数据的前提是其用以证明的技术效果在原申请文件中有明确记载。”
在(2014)行提字第8号(“阿托伐他汀钙”)的判决中明确“在专利申请日后提交的用于证明说明书充分公开的实验性证据,如果可以证明以本领域技术人员在申请日前的知识水平和认知能力,通过说明书公开的内容可以实现该发明,那么该实验性证据应当予以考虑”。
《审查指南》(2017版)对于补充试验数据的相关规定是“判断说明书是否充分公开,以原说明书和权利要求书公开的内容为准,对于申请日之后补交的实验数据,审查员应当予以审查。补交实验数据所证明的技术效果应当是所属技术领域的技术人员能够从专利申请公开的内容中得到的。”
因此,我们认为,当补交实验数据用于证明说明书充分公开时,如果能够基于说明书公开的内容,以本领域技术人员在申请日前的知识水平和认知能力,可以实现发明,且该技术效果是本领域技术人员在申请日根据说明书、附图以及公知常识能够确认的,则可以考虑该实验数据;而当进行创造性判断时,后补充的实验数据中的该技术效果是本领域技术人员在申请日从专利申请文件公开的内容可以直接、毫无疑义地确认的,则可以考虑该实验数据。否则违背了先申请制的原则。
二、实施瑞德西韦治疗2019新冠病毒引起的疾病的行为是否会侵犯吉利德公司的用途专利的专利权?
由于吉利德公司的796号用途申请目前还处于实审状态,是否能获得授权还不确定。故目前还不会存在侵犯用途专利专利权的风险。
但吉利德公司的该用途申请后续有可能获得授权,根据我们的经验预期,则其授权的权利要求可能是以下情形之一:
(1)瑞德西韦在制备治疗由SARS或MERS冠状病毒引起的疾病的药物中的应用,
(2)瑞德西韦在制备治疗由冠状病毒引起的疾病的药物中的应用;
(3)包含瑞德西韦的通式I化合物在制备治疗由SARS或MERS冠状病毒引起的疾病的药物中的应用;
(4)包含瑞德西韦的通式I化合物在制备治疗由冠状病毒引起的疾病的药物中的应用。
则根据全部技术特征对比原则可知,因SARS、MERS和2019新冠病毒虽然都是冠状病毒,有一定的相似性,但这三者的病毒株不同,核酸序列不同,则实施瑞德西韦治疗2019新冠病毒不会落入第(1)和(3)的保护范围,而可能落入第(2)和(4)的保护范围,即存在对保护第(2)和(4)种权利要求专利构成侵权的风险。
事实上通过前述分析还可以发现,由于专利法对于支持和公开充分的审查标准的一致性,则对于吉利德公司申请在先的796号用途申请和武汉病毒研究所的目标申请,我们可以大胆地预期:
由于796号用途申请并未涉及2019新冠病毒的任何实验数据,即便在疫情严重的当下将其批准用于临床试验,甚至最后能获批用于2019新冠病毒,但因为原说明书和实施例并未记载这些在后的试验数据,而且基于原说明书记载的内容也无法预期其可以应用于2019新冠病毒,故吉利德公司的796号用途申请涉及冠状病毒的主题即便能够获得授权,也应当限定在MERS或SARS类冠状病毒的应用上,即可能的授权主题为“(1)瑞德西韦在制备治疗由SARS或MERS冠状病毒引起的疾病的药物中的应用”。
同样地,武汉病毒研究所的目标申请因可能仅有对抗2019新冠病毒的试验数据,故其最可能的授权的主题为“(1)瑞德西韦在制备用于治疗由2019新冠状病毒引起的疾病的药物中的应用”。
如此,则吉利德公司的796号用途申请不会构成对后续实施瑞德西韦用于治疗由2019新冠病毒引起的疾病的侵权风险。
三、关于瑞德西韦的许可问题
基于前述分析可知,关于瑞德西韦真正核心的问题应该是瑞德西韦化合物专利的可能的侵权问题。因为该化合物于2011年7月22日申请,并已在中国获得授权,其专利保护期届满为2031年7月22日。若瑞德西韦在中国的临床研究证实有效,该药物获批,那中国在临床上将其用于治疗2019新冠病毒引起的疾病仍将受到吉利德所拥有的化合物专利权的限制。
在当前疫情防控形势严峻,已经导致全国公共卫生紧急状态的情况下,一旦确认瑞德西韦能够用于治疗我国的新型冠状病毒性肺炎,是否需要考虑对瑞德西韦的相关专利进行强制许可或将成为焦点。
●法律依据 ●
根据TRIPS协议第31条b款,若成员国面临国家紧急状态或者其他极端紧迫情况,或为了公共的非商业性目的而使用时,则可以免除征得权利人同意的义务,但应及时告知权利持有人。《TRIPS与公共健康多哈宣言》(简称“多哈宣言”)就实施专利药品强制实施许可制度、解决发展中国家成员方公共健康危机达成一致意见。根据多哈宣言,WTO的成员国有权决定构成国家紧急状况或其它紧急情况的条件,可以理解公共健康危机,包括与艾滋病、结核病、疟疾以及其他传染病有关的危机,构成上述国家紧急状态或其它紧急情况;多哈宣言承认WTO成员国政府有授权强制许可维护公共健康的主权权利。
在当前我国新型冠状病毒疫情的情况下,已经构成了TRIPS协议第31条b款的紧急状态,且我国政府有权决定该紧急状态。
我国现行《专利法》关于强制许可的规定主要是第四十九条至第五十一条,与本次疫情相关的主要是第四十九条“在国家出现紧急状态或者非常情况时,或者为了公共利益的目的,国务院专利行政部门可以给予实施发明专利或者实用新型专利的强制许可。”和第五十条“为了公共健康目的,对取得专利权的药品,国务院专利行政部门可以给予制造并将其出口到符合中华人民共和国参加的有关国际条约规定的国家或者地区的强制许可。”
而涉及当事人申请的第五十一条规定“一项取得专利权的发明或者实用新型比前已经取得专利权的发明或者实用新型具有显著经济意义的重大技术进步,其实施又有赖于前一发明或者实用新型的实施的,国务院专利行政部门根据后一专利权人的申请,可以给予实施前一发明或者实用新型的强制许可。在依照前款规定给予实施强制许可的情形下,国务院专利行政部门根据前一专利权人的申请,也可以给予实施后一发明或者实用新型的强制许可。”
现行的《专利实施强制许可办法》也有相关的具体规定。
第六条规定“在国家出现紧急状态或者非常情况时,或者为了公共利益的目的,国务院有关主管部门可以根据专利法第四十九条的规定,建议国家知识产权局给予其指定的具备实施条件的单位强制许可”。
第八条规定“一项取得专利权的发明或者实用新型比前已经取得专利权的发明或者实用新型具有显著经济意义的重大技术进步,其实施又有赖于前一发明或者实用新型的实施的,该专利权人可以根据专利法第五十一条的规定请求给予实施前一专利的强制许可。国家知识产权局给予实施前一专利的强制许可的,前一专利权人也可以请求给予实施后一专利的强制许可。”
因此,在目前疫情的情况下,如有必要,可以由国务院有关主管部门例如国家卫健委根据专利法第四十九条的规定建议国家知识产权局给予其指定的具备实施条件的单位强制许可。建议给予强制许可的发明专利应当至少包括瑞德西韦的化合物专利。
此外,根据《专利法》第五十一条和《专利实施强制许可办法》第八条,如果武汉病毒研究所关于瑞德西韦用于治疗由新型冠状病毒(2019-nCoV)引起的疾病的药物的新用途申请获得授权,由于该专利的实施必须依赖于吉利德关于瑞德西韦的化合物专利,所以武汉病毒研究所可以请求国家知识产权局给予实施吉利德关于瑞德西韦化合物专利的强制许可。如果其成功获得该专利的强制许可,吉利德将也有权请求国家知识产权局给予其实施武汉病毒研究所新用途发明专利的强制许可。
对于申请人申请强制许可的该种可能情形,从该某种度来说,武汉病毒研究所提交专利申请,且能尽快获得授权,确实可以成为争取获得强制许可的一种有益尝试。
●可操作性 ●
众所周知,尽管国际上已经有众多国家启动了强制许可,例如泰国于2006年至2008年四次针对依非韦伦、洛匹那韦/依托那韦等的强制许可,印度于2013年针对拜耳公司的索拉菲尼的强制许可,巴西政府于2007年针对依非韦伦的强制许可等等,但我国至今为止尚未给予任何专利以强制许可,即根据法律规定,该项制度有存在空间,但还从未被使用。因此,该药是否能启动强制许可,大家均拭目以待。
事实上,2005年曾因禽流感危机爆发时,讨论过达菲的强制许可问题。但罗氏公司在面临强大的公共卫生压力的情况下为了避免强制许可,主动将达菲(通用名“奥司他韦”)先后授权上药集团和东阳光生产许可。顺便提及的是,达菲同样是由吉利德公司于90年代研发的一款小分子药物GS4104。吉利德公司将药物使用权转让给罗氏公司,由其于1993年10月获得FDA批准并成功上市。
无论是启动强制许可,还是由原研公司授权其他单位或个人来实施其专利,都将面临时间的紧迫性的问题。
对于瑞德西韦的化合物专利的实施,根据我们了解的信息,国内有相当多可以合成出瑞德西韦化合物的企业。2月6日,湖南华纳大药厂在其官网宣称,其仿制瑞德西韦工艺攻关取得突破,拟争取在6-7月份实现对国家药监局的注册申报,在获得国家局的批准后组织商业化生产,为抗击疫情贡献力量[4]。
不过,众所周知,瑞德西韦化合物是原料药,制成给患者服用的药物是包含瑞德西韦原料药和其他各种药学上的辅料的制剂(例如口服片剂,注射液等等)。但目前该制剂的剂量、剂型等均不确定,很多数据还有赖于临床研究。且考虑到剂量、毒性和副作用的问题,在短时间内完成制剂的研发,并申报成功上市,其难度很高。
因此,即便国家知识产权局给予相关实施主体瑞德西韦相关专利的强制许可,或者吉利德公司授权许可相关单位实施其专利,要在短时间内制备出符合新药审批标准的制剂仍将面临技术上的困难,专利的强制许可或授权许可并不能扫除患者在瑞德西韦药品可及性方面所面临的障碍。
事实上,吉利德公司于2020年2月8日,在其公众号中提出,“我们认为,现阶段讨论任何强制许可或其他类型许可还为时过早。我们并未与监管部门就吉利德的生产供应成本或财务回报进行过任何的讨论”。
作者申明:本文由知元团队共同完成,刘元霞执笔,张炳楠、陈玉平、黄越和张龙提供案例检索和各部分观点支持。任何人未经允许,不得转载。


上一篇:在后公开的证据是否能用于证明发明的创造性
下一篇:知元观点|瑞德西韦(Remdesivir)合成工艺的若干专利问题