作者:吕少楠、张炳楠


要点速览
一、发明专利的审查包括对实验数据真实性和合法性的审查。
二、根据现有证据,难以认定“苯酚专利”的实验数据和安全性数据不符合《专利法》的相关规定。
三、专利审查程序难以规制非法行医行为,其依法由其他部门规制和惩戒。
新冠肺炎疫情期间,李跃华因使用“穴位注射苯酚”的方法治疗疾病,受到湖北省卫计委的调查,后被认定构成非法行医行为。除责成属地卫生健康行政部门依法严肃查处外,该调查报告还“建议有关部门审查李跃华持有发明专利(ZL201110136639.9,下称“苯酚专利”)的详细情况。”
在上述事件构成网络热点后,出现的评论文章颇多。通常,在与技术相关的热点事件中,是否存在授权专利、是否应当被授予专利权等问题,总是免不了吸引业内人士讨论,或成为坊间的谈资,而且此类问题在医疗健康领域受到的关注度会更高。笔者发现,在李跃华事件中,某些评论仍一如既往地包含着对专利基础知识以及专利审查工作的误解。例如,《李跃华该不该抓?这个问题不辩论清楚事关千万人的健康和生命!》[1]中有如下评论:

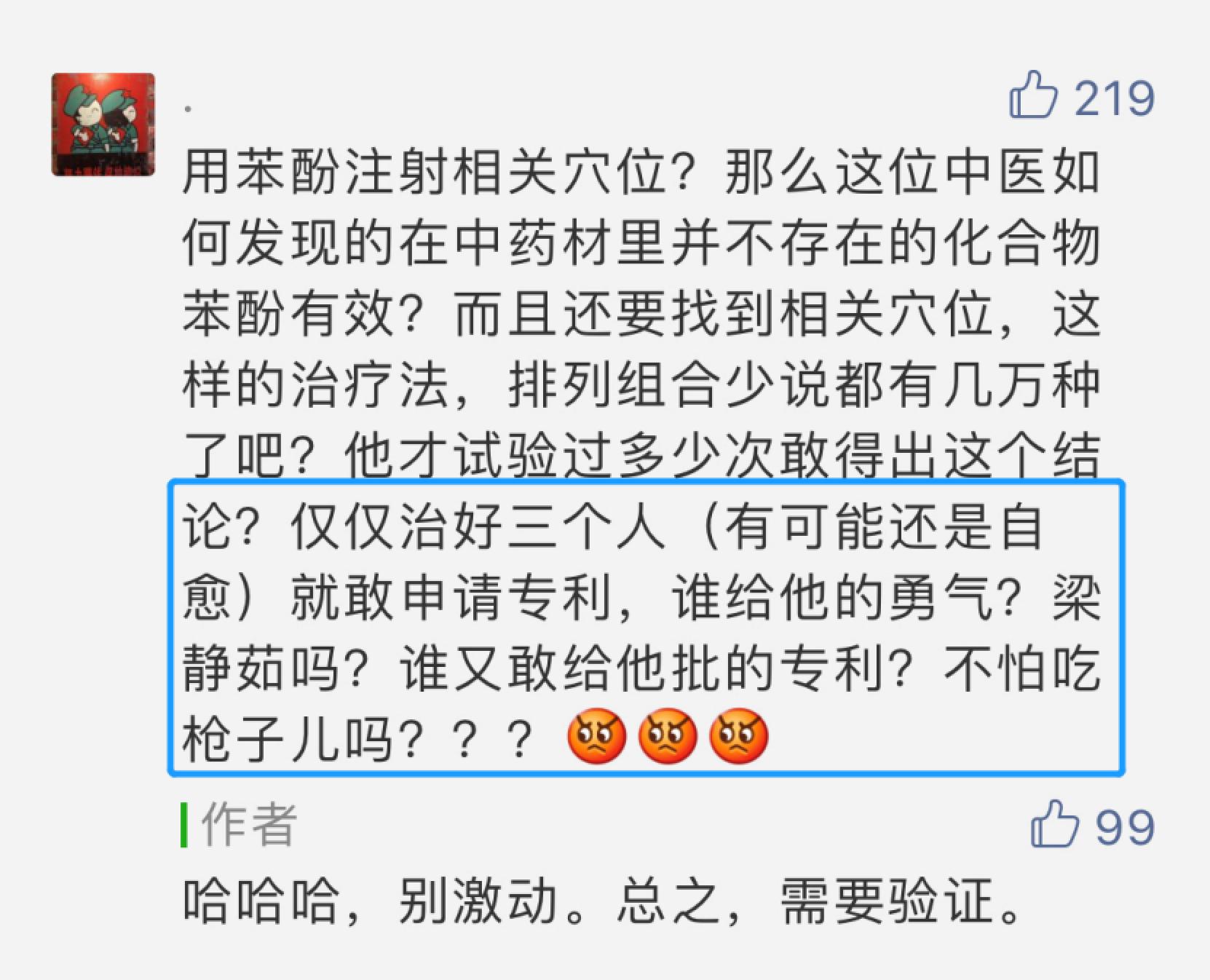
鉴于该文章浏览量已逾十万,受众广泛,为避免误导加深,本文结合苯酚专利的内容,对涉及专利的争议进行解释和说明。概括来讲,目前涉及专利的争议焦点主要包括:
1. 根据目前证据,是否能够认定苯酚专利的实验数据真实性或用药安全性存疑,涉案专利不符合授权条件?
2. 苯酚专利授权是否意味着李跃华能够将其注射剂用于人体?
3. 是否应当以非法行医为理由驳回苯酚专利?
一、发明专利的审查包括对实验数据真实性和合法性的审查
《专利法》第三十九条规定:“发明专利申请经实质审查没有发现驳回理由的,由国务院专利行政部门作出授予发明专利权的决定”,而《专利法实施细则》第五十三条则对应当予以驳回的情形进行详细规定。其中,对于苯酚专利中实验数据真实性和安全性,主要依据《专科法》第五条第一款和第二十六条第三款予以规制。
值得注意的是,李跃华就苯酚专利的技术方案还提交了PCT国际申请(申请号PCT/CN2012/000614,公布号WO/2012/159444A1),并且其国际检索单位书面意见认可了其新颖性、创造性和实用性。
(一)《专利法》第五条第一款
《专利法》第五条第一款规定“对违反法律、社会公德或者妨害公共利益的发明创造,不授予专利权。”
上述条款的审查范围包括整个申请文件,不局限于权利要求书。
苯酚专利授权公告的权利要求1保护“一种包括苯酚在常温下的饱和溶液和生理盐水的组合物在制备穴位注射剂中的用途,其特征在于:上述组合物中苯酚在常温下的饱和溶液和生理盐水的混合比例为0.5~2:100。”
经核实,该专利说明书包括4个实施例,其中实施例4记载“苯酚在常温下的饱和溶液2ml,利多卡因5ml,生理盐水100ml”,“总注射量达到10-30mL”。由于实施例4中苯酚的注射剂量明显高于其他实施例,因此以该实施例的注射量上限进行计算苯酚的给药量为48mg,其中苯酚常温下在水中的溶解度以8g/100mL计。
另外,苯酚也是我国药典可接受的辅料,在其他专利中也可见添加苯酚的制剂,例如:
诺和诺德股份有限公司的授权专利“胰岛素制剂”(专利号ZL201380030897.6),其专利授权公告的权利要求1中,苯酚最高含量为35mM。上述专利对应的制剂产品德谷胰岛素注射液(诺和达)已通过临床试验,获批在国内上市(国药准字J20171095、国药准字J20171096),制剂规格为3mL。
通化东宝药业股份有限公司的授权专利“一种稳定的甘精胰岛素注射液及其制备方法”(专利号ZL201510061592.2)的实施例1中,苯酚用量为1.2mg/mL。
上海上药第一生化药业有限公司的授权专利“一种肝素钠注射液及其制备方法”(专利号ZL201410341450.7),其实施例3中苯酚的用量为50g/10L,即5mg/mL。
以诺和诺德为例,将部分与剂量和安全性相关的数据汇总如下:

由上述对比可知,尽管苯酚专利中的最高注射剂量高于诺和诺德,但与致死量和LD50相比,认为其制剂存在安全性问题缺乏足够的依据。而且,尽管本专利公开了将其制剂用于治疗扁桃体炎症、慢性鼻炎、颈椎病、带状疱疹等疾病的治愈率存在差异,但没有证据证明患者发生安全性风险或不良反应。
此外,根据国家标准GB/T 21709.6-2008(针灸技术操作规范第6部分:穴位注射)可知,苯酚专利中的给药方法已应用于临床。
因此,在缺少相反证据的情况下,专利审查中难以直接将涉案专利中的穴位注射低剂量苯酚视为“注射致死量的消毒剂”,并依据专利法第五条第一款驳回。
(二)《专利法》第二十六条第三款
《专利法》第二十六条第三款规定“说明书应当对发明或者实用新型作出清楚、完整的说明,以所属技术领域的技术人员能够实现为准;必要的时候,应当有附图。摘要应当简要说明发明或者实用新型的技术要点。”另外,对于化学产品的医药用途实验数据和使用效果,《审查指南》第二部分第十章第3节中也作出了进一步的规定:如本领域技术人员根据现有技术无法预测其声称的用途,则说明书中应当记载对于本领域技术人员来说,足以证明其用途并能解决所要解决的技术问题或者达到所述效果的实验数据。
就本专利而言,说明书实施例中记载了使用其制剂治疗反复发作的化脓性扁桃体炎及扁桃体肿大、慢性鼻炎、颈椎病、带状疱疹这四类疾病的治愈率和/或有效率。可能有观点认为,上述实施例记载对扁桃体炎症、慢性鼻炎、颈椎病、带状疱疹等的治愈率非常高,毫无疑问实验数据真实性存疑,审查员应当要求申请人提交真实性证明。但应当注意的是,行政机关作出如上认定必须有事实和法律依据。一方面,根据该专利实施例的记载,其对于扁桃体炎的38例和带状疱疹的25例治愈率为100%,而对慢性鼻炎的治愈率为65%,颈椎病的治愈率为75%,可见本专利的制剂和疗法对几种疾病的治愈率有所差异。而从善意推定申请人/发明人的角度考虑,也不宜直接认定“疗效好=数据造假”。另一方面,由于穴位疗法较为特殊,发明人可能认为西药领域的细胞级实验难以体现穴位疗法和药剂相结合后的技术效果,或者受实验条件限制无法完成此类实验,仅可提供其声称真实的相关病例记录。例如,李跃华2013年发表的文章“一种穴位注射剂——微量苯酚在临床中的应用”[3]中也提及:“由于条件有限,本院不能检测病毒的种类,不能测量治疗前、中、后期的病毒数量,因此不能拿出此方法杀灭病毒的直接证据。”在此情况下,审查员应当如何判断病例记录的真实性,仍难以存在统一的标准。
事实上,诚实信用原则贯穿于专利审查程序的始终,也具体体现在相关法律条款的适用过程中。国家知识产权局第45号令《关于规范专利申请行为的若干规定》早在2007年已对专利申请人及其代理机构恪守诚实信用原则提出了更为具体的要求,并于2017年第75号令中进行修订。即使数据造假的手段隐蔽,但一旦有证据表明申请人依靠虚假数据获得专利授权,则该专利权可通过专利无效程序宣告无效,当事人的行为也会依法受到惩戒。
因此,鉴于穴位注射的治疗方案和效果数据较为特殊,在没有相反证据证明其试验数据存在矛盾或不真实的情况下,审查员难以认定本案实验数据不真实。
综上,笔者认为,在对苯酚专利审查中没有发现可以作为驳回理由的真实性、安全性问题的情况下,作出授予专利权的决定符合《专利法》的规定。在实践中,此类问题也可通过公众意见或专利无效程序予以解决。2014年,国家知识产权局专利复审委员会在第24286号无效宣告请求审查决定中也强调:“倘若专利申请文件中提供了不实的技术信息,并籍此被授予专利权,则其既无益于促进科学技术进步和经济社会发展,也会使申请人从中不当获利,损害社会公众的利益。这一明显有违诚实信用原则的行为已经违背了专利法的立法本意,继续维持其专利权有效有悖于专利法的根本要求。”[4]
二、专利授权不代表药品可以用于人体
专利获得授权,并不意味着药品能够上市,更不能理解为药品可以用于人体治疗疾病。通常,新药物在上市前需要经历临床前研究、临床研究、药品注册获批等环节,而医药企业为争取利益最大化,往往需要结合研发进度进行合理的专利布局,某些专利申请将在临床研究开始之前提交专利申请,但相当一部分的药品研发可能在临床研究和临床前研究过程中由于种种原因夭折。以瑞德西韦为例,虽然其化合物专利申请已在中国获得授权,但其说明书中仅提供了细胞水平的实验数据,目前该药物仍在进行临床研究[5]。即使该药物临床试验未能通过,也不能以此为理由宣告其专利权无效。
此外,即使在临床试验中发现药物的不良反应,也不意味着该药物必然无法获得批准。根据《药品管理法》第二十四条的规定,除未实施审批管理的中药材和中药饮片外,在我国上市的药品,应当经国务院药品监督管理部门批准,取得药品注册证书。并且,申请药品注册,应当证明药品的安全性、有效性和质量可控性。而根据《药品注册管理办法》第三十一条的规定,申请新药注册,应当进行临床试验,其中包括对药品安全性和不良反应的评价。并且,对于存在不良反应的药物,仍需评价患者用药的利益与风险关系,这表明并非任何程度和范围的不良反应都将导致药品审批失败。医药研发是个循序渐进的过程,因为药品存在副作用就驳回专利申请是不切合实际需求的。相反,如以此为标准审批药品或药品专利申请,医药企业不可能愿意花费大量成本去开发新药,否则一旦因为微小的副作用无法获批,成本将无法收回。患者的疾病治疗也会受到阻碍,最终减损了社会公众的总福利。
根据《中华人民共和国执业医师法》第三十九条、《医疗机构管理条例》第四十四条、《刑法》第三百三十六条规定,非法行医行为,根据其行为情节严重程度,将受到县级以上人民政府卫生行政部门(卫健委)或司法机关的惩罚。
由李跃华事件的调查报告可知,李跃华并不具备行医资质,构成非法行医行为。可能有观点认为,既然李跃华没有行医资质,而且在苯酚专利的实施例中自认了将药品用于治病的行为,事后也承认实施了为他人用药治病的行为,那么国家知识产权局是否放任了李跃华的非法行医行为,是否应当要求发明人出示行医资质,继而以违反专利法第五条为由驳回本申请?
笔者认为,上述观点可能混淆了政府各部门的职能范围。现实中,可能存在发明人制造了药物,将该药物交由具有行医/测试资质的人考察疗效,即发明人不必然是实施治疗行为人的情况。并且,发明人还有可能在专利提交后考取了行医资质。如果对医药类产品进行专利审查的同时,还要求国家知识产权局核实发明人、实验人员等的行医资质,确认是否实施了非法行医的行为,显然存在极大的难度。并且,在非法行医行为目前由卫健委和司法机关管辖的情况下,国家知识产权局代为审核行医资质,不仅影响专利审查的行政效率,而且有越俎代庖之嫌。
当然,笔者认为,考虑到现阶段公众对生命健康的重视程度,如果公众对专利审查工作的误解持续扩大,卫健委等卫生行政部门也可以考虑会同国家知识产权局商议,针对在医药健康领域开展以专利文献基础的联动工作的可能性,以及对相应的技术手段进行更深入的讨论。
四、结语
社会规则是由法律法规和道德规范共同构成的。专利法、药品管理法、执业医师法、刑法等法律规范分别着眼于促进科技进步、保护公众健康、惩戒犯罪行为等不同的立法目的,职能各不相同。寄希望于依靠《专利法》解决医疗体系框架下的所有问题显然是不现实的。对于公众而言,应当知晓法律赋予行政机关和公众的权利边界,以及由此设立的规则,而不能误认为专利证书是行医用药的通行证、催化剂,希望专利审查机构同时承担起规范行医资质的责任。事实上,我们从疫情发展进程中能够学习到的是,在各类消息、事件错综复杂的情况下,如果对相关法律缺少了解,则应当坚持对术业有专攻的尊重,避免偏听偏言、先入为主或主观臆断。
参考文献
[1] “李跃华该不该抓?这个问题不辩论清楚事关千万人的健康和生命!”,微信公众号:科学有故事。
[2] “苯酚中毒”,百度百科,https://baike.baidu.com/item/%E8%8B%AF%E9%85%9A%E4%B8%AD%E6%AF%92/10188153?fr=Aladdin。
[3] “一种穴位注射剂——微量苯酚在临床中的应用”,《求医问药》下半月刊,2013年,第11卷,第2期,第51页。
[4]. 国家知识产权局专利复审委员会第24286号无效宣告请求审查决定。
[5]. “知元观点|瑞德西韦系列之二——事急从权?III期临床加速启动的相关法规简析”,刘元霞,微信公众号:知元同创知识产权代理事务所。
上一篇:知元观点|电子专利证书一点通
下一篇:知元观点|浅析欧洲专利申请的形式与要求