一、前 言
2018年8月13日,国家知识产权局专利复审委员会作出第36902号无效宣告请求审查决定,以说明书公开不充分为由,宣告辉瑞产品公司持有的专利号为ZL00816941.1、发明名称为“吡咯并[2,3-d]嘧啶化合物”的发明专利全部无效。
该案是继业界著名的“阿托伐他汀钙”(“立普妥”)晶型无效案(最高人民法院(2014)行提字第8号行政案)之后的又一公开不充分案例,这也应该是近些年来为数不多的以说明书公开不充分为理由宣告无效的化合物无效决定。
笔者借助该案,梳理一下有关公开不充分的相关法律规定及法律实践。
二、相关法律规定及法律实践
《专利法》第二十六条第三款规定“说明书应当对发明或者实用新型作出清楚、完整的说明,以所属技术领域的技术人员能够实现为准。”
说明书应当满足充分公开的要求,是专利法律体系中的帝王条款,也是撰写发明和实用新型专利说明书的最为重要的要求。作为获得国家授予的独占权的前提条件,申请人必须向社会公众充分公开其发明创造的内容,这样才能实现专利法第一条规定的有利于发明创造的推广利用、促进科学技术进步和创新的立法宗旨。
与《专利法》配套的《审查指南》相关的规定如下表1-3所示。
历次《专利法》对于公开不充分的上述规定并未发生变化,但《审查指南》变化较多。正是由于《审查指南》对于实验数据要求的变化,导致在实践中,尤其是医药化学领域的案件审查中,可能会出现法律适用的不同,有些甚至会导致案件结果不同。
表1

历次审查指南对照表(关于实现)
表2

历次审查指南对照表(关于实验数据)
表3
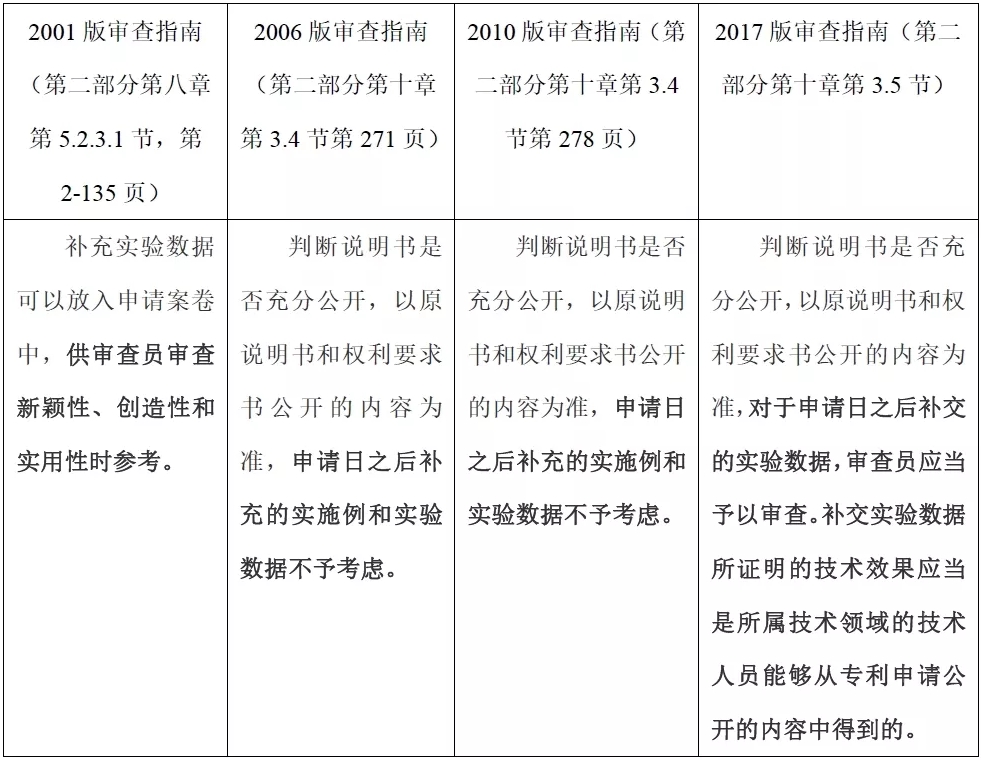
历次审查指南对照表(关于补充实验数据)
基于表2内容可知,对于实验数据,《审查指南》(2001)的要求是,应当提供新的药物化合物或药物组合物实验的定性或定量数据;这与《审查指南》(2006)在上述规定之前增加的如下内容“如果所属技术领域的技术人员无法根据现有技术预测发明能够实现所述用途和/或使用效果,则说明书中还应当记载对于本领域技术人员来说,足以证明发明的技术方案可以实现所述用途和/或达到预期效果的定性或者定量实验数据”并不一致。通过这两版《审查指南》的简单对比可见,笔者认为《审查指南》(2001)对实验数据的要求更为严格。
但是通过仔细对比各版《审查指南》的规定可知,尽管《审查指南》(2001)对于试验数据要求非常严格,但只要提供定性或定量试验数据,则就满足了充分公开的要求。而且,该版《审查指南》(2001)对于什么是定性试验数据,相对宽松,例如本发明化合物具有抗高血压活性可能也能符合定性试验数据,并未像后续修改的《审查指南》的要求那么严格。此外,根据《审查指南》(2001)对于试验数据可以补交也相对宽松,补交的试验数据供审查三性时参考满足充分公开的要求之后,可以通过。
由此可能出现部分专利一旦满足定性试验数据要求充分公开,则会因可以补入补交的试验数据可以证明创造性,从而满足创造性的规定。由此出现的可能现象是应当记载在申请文件中的试验数据被隐藏而不符合“公开换保护”的立法本意;另外,还会出现一部分申请在申请提交之日起并未完成试验,但通过申请日之后的试验数据而抢占了在先申请日,这显然违背了先申请的原则。
在此前提下,《审查指南》(2006)对于试验数据的要求变得更为合理。即不再将提交试验数据作为一个必须的条件,而是由本领域技术人员基于现有技术对是否需要实验数据进行判断,避免了一刀切的做法[1]。
当然,为了配合公开不充分的上述修改,《审查指南》(2006)在2001版基础上,删除了“补充实验数据可以放入申请案卷中,供审查员审查新颖性、创造性和实用性时参考。”删除的原因在于,并非所有这样的信息都是可以参考的,因而需要审查员根据实际补充的内容及案件的具体情况,确定是否需要考虑[2]。
事实上,实践中,对于此类依赖于实验数据进行验证的发明,通常会通过公开不充分和创造性这两个法条予以约束。
上述再审案中,最高院也对《审查指南》各版本的适用原则予以明确。“由于本专利申请文件的修改是否符合法律规定这一实体法律问题应适用1992年修订的专利法及其实施细则的规定,与此相适应,该实体法律问题应适用与1992年修订的专利法及其实施细则相配套的、在本专利申请日时施行的《专利审查指南》,即1993年3月10日公布的《专利审查指南》。”,“若适用本案专利申请日时尚不存在的2001年版或者2006年版《专利审查指南》,则违背法不溯及既往这一基本法治原则,损害专利申请人对生效法律的正当信赖。”
34432号无效宣告请求审查决定所涉专利的申请日为2003年1月16日,优先权日为2002年1月17日,故相应地应当适用2001年专利法、专利法实施细则和《审查指南》(2001)。若如此适用,则会由于该专利没有记载应当提供的定性或定量试验数据,而不满足充分公开的要求,这也是该案在实审过程中第一次以公开不充分被驳回的同样理由。
顺便提及的是,该案的审查历史非常曲折,母案(申请号为:03802268.0)实审驳回并被复审委维持驳回,后驳回生效(2011年9月14日),其驳回理由即为公开不充分。专利权人将该申请进行分案(专利号为:ZL201110029600.7),实审审查员于2012年03月29日以同样的公开不充分理由驳回,但在复审委做出的决定(2014年8月18日)中,则认可公开不充分,最终该案于2015年4月8日授权公告。
非常有意思的是,该案的上述时间进程,正好与中美从2012年初开始的关于知识产权的磋商时间一致。2013年12月5日,在习近平主席和奥巴马总统达成的建设中美新型大国关系的共识的“关于加强中美经济关系的联合情况说明”[3]中指出,“中方确认,中方的《专利审查指南》允许专利申请人在提交专利申请后提交额外的数据,《专利审查指南》适用《中华人民共和国立法法》第八十四条,确保药品发明获得专利保护。中方确认,上述解读在实际操作中已实施。”
这也是业界均知晓的,从上述中美谈判之后,发明专利很少以公开不充分为由驳回或无效,继而以不具有创造性为由驳回或无效的案例增加。据业内推测,这可能是2012-2018这六年间,甚少出现公开不充分案的一个主要原因。本文开篇提到的两个案例的时间跨度(2008年的公开不充分无效案至2018年的公开不充分无效案)也基本与此时间点吻合。这也就可以理解,34432号前述案例最终以创造性为由无效的原因所在了。
上一篇:专利申请中的科研不端行为初探(三)
下一篇:药物杂质化合物如何获得专利保护


